Aller directement à:
Qualité de l’eau de surface des rivières (théorie)
Qualité de l’eau de surface des lacs (théorie)
| 2.5.1 Bassin de la rivière Saint-Charles | Rivières – hydrographie et berges Rivières – qualité de l’eau Lacs – caractéristiques et qualité de l’eau Milieux humides |
|---|---|
| 2.5.2 Bassin de la rivière du Cap Rouge | Rivières – hydrographie et berges Rivières – qualité de l’eau Lacs – caractéristiques et qualité de l’eau Milieux humides |
| 2.5.3 Bassin de la rivière Beauport | Rivières – hydrographie et berges Rivières – qualité de l’eau Lacs – caractéristiques et qualité de l’eau Milieux humides |
| 2.5.4 Bassin du lac Saint Augustin | Rivières – hydrographie et berges Rivières – qualité de l’eau Lacs – caractéristiques et qualité de l’eau Milieux humides |
| 2.5.5 Bassin du ruisseau du Moulin | Rivières – hydrographie et berges Rivières – qualité de l’eau Lacs – caractéristiques et qualité de l’eau Milieux humides |
| 2.5.6 Bordure du Fleuve | Rivières – hydrographie et berges Rivières – qualité de l’eau Lacs – caractéristiques et qualité de l’eau Milieux humides |
La qualité des eaux de surface, un élément-clé de tout portrait de bassin versant, s’évalue en comparant les caractéristiques de l’eau de surface des cours d’eau avec des valeurs de référence établies. Certains paramètres physico-chimiques et bactériologiques doivent en effet demeurer à l’intérieur d’une gamme de limites reconnues pour assurer la sécurité des différents usages de l’eau. Ceux-ci peuvent se classer en 4 catégories, soit
1) la consommation d’eau et d’organismes aquatiques;
2) la protection de la vie aquatique (toxicité aigüe et chronique);
3) la protection de la faune terrestre piscivore;
4) la préservation des activités récréatives et de l’esthétique (contact primaire et secondaire).
Il est par exemple possible de déterminer les seuils pour permettre des usages récréatifs potentiels de l’eau comme la baignade, les activités nautiques, ainsi que la protection des plans d’eau contre l’eutrophisation. L’analyse de l’état qualitatif des cours d’eau rend ainsi possible l’identification des variables limitant la qualité des eaux et permet de cibler ceux où il existe une problématique (Gangbazo, 2011).
Afin de faciliter l’évaluation de la qualité de l’eau durant la période estivale (de mai à octobre) et les usages qu’elle autorise, un indice a été développé par la Direction du suivi de l’état de l’environnement (DSÉE) du MDDELCC, l’IQBP (indice de qualité bactériologique et physico-chimique de l’eau). Celui-ci représente un outil de synthèse permettant d’attribuer aux rivières du Québec une classe générale de qualité de l’eau qui permet une comparaison géographique des données.
Jusqu’à 10 variables peuvent être utilisées pour caractériser un échantillon d’eau. Toutefois, seules 6 d’entre elles ont été retenues par le MDDELCC en 2011 pour définir l’indice de qualité, soit le phosphore total, les coliformes fécaux, les matières en suspension, l’azote ammoniacal, les nitrites-nitrates et la chlorophylle α totale. On parle donc d’IQBP6. La turbidité, autrefois retenue comme paramètre pour déterminer l’indice de qualité (IQBP7), n’est plus utilisée puisqu’elle était trop liée à des facteurs environnementaux indépendants des impacts humains (Gangbazo, 2011). Les valeurs de chacune des variables sont ensuite comparées à des critères reconnus pour les rivières du Québec. Le tableau 2.5.1 résume ces critères de qualité de l’eau et les seuils pour les usages impliqués.
Tableau 2.5.1 : Tableau synthèse des critères de qualité de l’eau utilisés dans l’indice IQBP6 selon les principaux usages de l’eau de surface.
| Variables | Code | Unités | Critères | ||
|---|---|---|---|---|---|
| Valeurs | Usage concerné | Source | |||
| Coliformes fécaux | CF | UFC/100 ml | 200 UFC/100 ml | Activités récréatives (contact primaire) | MDDELCC, 2015 |
| 1000 UFC/100 ml | Activités récréatives (contact secondaire) | MDDELCC, 2015 | |||
| Phosphore total | PTOT | mg/l | 0,02 mg/l | Prévention de l’eutrophisation pour cours d’eau se déversant dans un lac ou un réservoir | MDDELCC, 2015 |
| 0,03 mg/l | Prévention de l’eutrophisation des cours d’eau | MDDELCC, 2015 | |||
| Chlorophylle totale | CHLA-T | mg/m³ ou μg/l | 8,6 mg/m³ | Niveau satisfaisant du sous-indice chlorophylle α de l’IQBP | Hébert, 1997 |
| Azote ammoniacal | NH3 | mg/l | 0,2 mg/l | Prévention de la contamination (eau et organismes aquatiques). La présence d’azote ammoniacal à des concentrations plus élevées peut compromettre l’efficacité de la désinfection. | MDDELCC, 2015 |
| Nitrites / nitrates | NOx | mg/l | 1 mg/l (nitrites)10 mg/l (nitrites et nitrates) | Concentration maximale pour l’eau potable | MDDELCC, 2015 |
| 0,06 mg/l (nitrites) | Protection de la vie aquatique effet aigu | MDDELCC, 2015 | |||
| 0,02 mg/l (nitrites)2,9 mg/l (nitrates) – en révision | Protection de la vie aquatique effet chronique | MDDELCC, 2015 | |||
| Matières en suspension | MES | mg/l | Augmentation maximale de 25 mg/L par rapport à la concentration naturelle ou ambiante | Protection de la vie aquatique effet aigu | MDDELCC, 2015 |
| Augmentation moyenne maximale de 5 mg/L par rapport à la concentration naturelle ou ambiante | Protection de la vie aquatique effet chronique | MDDELCC, 2015 | |||
| 13 mg/l | Valeur guide séparant les classes satisfaisantes et douteuses de l’IQBP | Hébert, 1997 | |||
Parmi les critères présentés, le critère de vie aquatique chronique (CVAC) est la concentration la plus élevée d’une substance qui ne produira aucun effet néfaste sur les organismes aquatiques (et leur progéniture) lorsqu’ils y sont exposés quotidiennement pendant toute leur vie. Le critère de vie aquatique aigu (CVAA) est la concentration maximale d’une substance à laquelle les organismes aquatiques peuvent être exposés pour une courte période de temps sans être gravement touchés (MDDELCC, 2015).L’IQBP6 est décomposé en sous-indices correspondant aux paramètres mesurés. Pour une eau échantillonnée, la valeur analytique de la médiane de chacune des 6 variables est donc transformée en sous-indice allant de 0 à 100, à l’aide d’une courbe d’appréciation de la qualité de l’eau (figure 2.5.1; Hébert, 1997). La variable ayant la valeur de sous-indice la plus basse dictera l’indice final, soit la valeur de l’IQBP6. Celui-ci permet de définir cinq classes de qualité de l’eau :
A (80 – 100) Eau de bonne qualité permettant généralement tous les usages, y compris la baignade.
B (60 – 79) Eau de qualité satisfaisante permettant généralement la plupart des usages.
C (40 – 59) Eau de qualité douteuse, certains usages risquent d’être compromis.
D (20 – 39) Eau de mauvaise qualité, la plupart des usages risquent d’être compromis.
E (0 – 19) Eau de très mauvaise qualité, tous les usages risquent d’être compromis.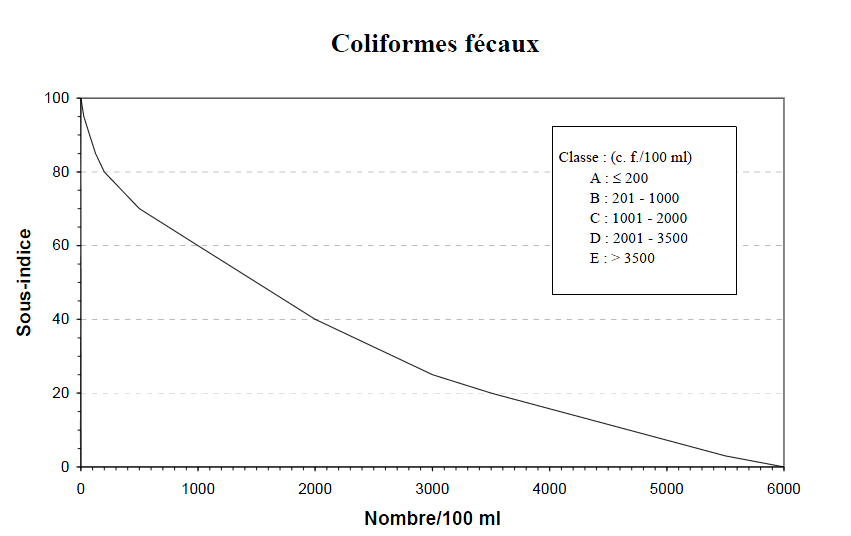 Figure 2.5.1 : Exemple d’une courbe d’appréciation de la qualité de l’eau concernant les taux de coliformes fécaux (Hébert, 1997)
Figure 2.5.1 : Exemple d’une courbe d’appréciation de la qualité de l’eau concernant les taux de coliformes fécaux (Hébert, 1997)
Plusieurs variables doivent donc être évaluées pour permettre de définir la qualité de l’eau d’une façon uniforme. Lorsque trop peu de données existent, il est toutefois possible de se baser sur l’analyse individuelle de chacun des paramètres pour juger de la qualité de l’eau. On peut par exemple se référer à un usage particulier de l’eau et à la fréquence à laquelle le critère de qualité qui lui est lié est dépassé (Gangbazo, 2011). La qualité de l’eau est alors classée dans l’une des quatre catégories (excellente, satisfaisante, douteuse, mauvaise) selon le pourcentage d’analyses qui sont supérieures à un critère donné pour chacun des paramètres. Cette méthode permet la comparaison de plusieurs stations pour un même intervalle de temps. Il est aussi possible de déterminer la variation temporelle d’un paramètre analysé lorsqu’on dispose d’une série de données réparties sur plusieurs années. On peut alors constater l’évolution des paramètres suite au traitement statistique des données (Gangbazo, 2011).
L’Indice Diatomées de l’Est du Canada (IDEC) a été élaboré en 2002 et 2003 pour les rivières du Québec (Lavoie et al., 2006). Il s’agit d’un indice d’intégrité écologique basé sur la structure des communautés de diatomées benthiques. Celles-ci s’installent dans des milieux répondant à leurs exigences écologiques, et intègrent les variations de la physicochimie de l’eau (phosphore azote, pollution organique et minérale) sur une période variant d’une à cinq semaines. Il existe par conséquent une grande variabilité des communautés de diatomées en fonction des conditions écologiques, du niveau de perturbation et de la pollution du milieu où elles sont retrouvées.
Il devient possible de classifier les milieux selon leur niveau d’intégrité écologique en comparant les communautés benthiques avec celles analysées pour l’ensemble du Québec et qui constituent un gradient de référence. Pour un échantillon donné, l’assemblage des diatomées identifiées permettra de positionner cet échantillon par l’analyse de la distance ou de la similarité de la communauté de l’échantillon avec les communautés de diatomées du gradient. Des cotes de 1 à 100 (Tableau 2.5.2) indiquent la position de l’échantillon. Une cote de 1 indiquera un niveau très faible d’intégrité écologique, soit un milieu très pollué et perturbé, alors qu’une cote de 100 indique un milieu « idéal » non pollué et non perturbé. La valeur de l’indice traduit la « distance écologique » entre une communauté de diatomées et sa communauté de référence. L’indice permet de cibler les affluents problématiques, le cas échéant, ou de détecter dans l’avenir ceux qui subissent un enrichissement en nutriments ou une détérioration, pouvant contribuer à l’eutrophisation d’un lac (Lavoie et al., 2006).
Par ailleurs, la comparaison d’analyses d’échantillons d’eau de la rivière Saint-Charles montre qu’il existe une corrélation très étroite entre les résultats de l’IDEC et ceux de l’IQBP (Hébert, 2007). Deux sous-indices ont été développés afin de tenir compte du pH naturel des cours d’eau. En effet, les communautés de diatomées sont différentes selon qu’elles se trouvent soit dans les eaux de surface naturellement neutres ou légèrement acides, soit dans des eaux alcalines; (Grenier et al., 2006). L’IDEC neutre fut développé pour le suivi des rivières dont le pH naturel est neutre ou légèrement acide (pH < 7,6) et l’IDEC-alcalin, pour le suivi des rivières dont le pH naturel est alcalin (pH > 7,6, voir tableau 2.5.2). Le choix de l’IDEC, neutre ou alcalin, s’est fait à partir d’une analyse des cartes géologiques et des cartes présentant des dépôts de surface de la région à l’étude. L’identification des diatomées a été réalisée à partir du Guide d’identification des diatomées des rivières de l’Est du Canada (Lavoie et al., 2008).
Tableau 2.5.2 : Limites des classes de l’IDEC et éléments d’interprétation. Des exemples de rivières appartenant à chaque classe, de chacun des sous-indices, sont indiqués. Les valeurs de l’IDEC de ces rivières furent calculées en 2002 et 2003 par Lavoie et al. (2006). La position des sites d’échantillonnage dans le bassin versant est indiquée (am : amont ; av : aval). 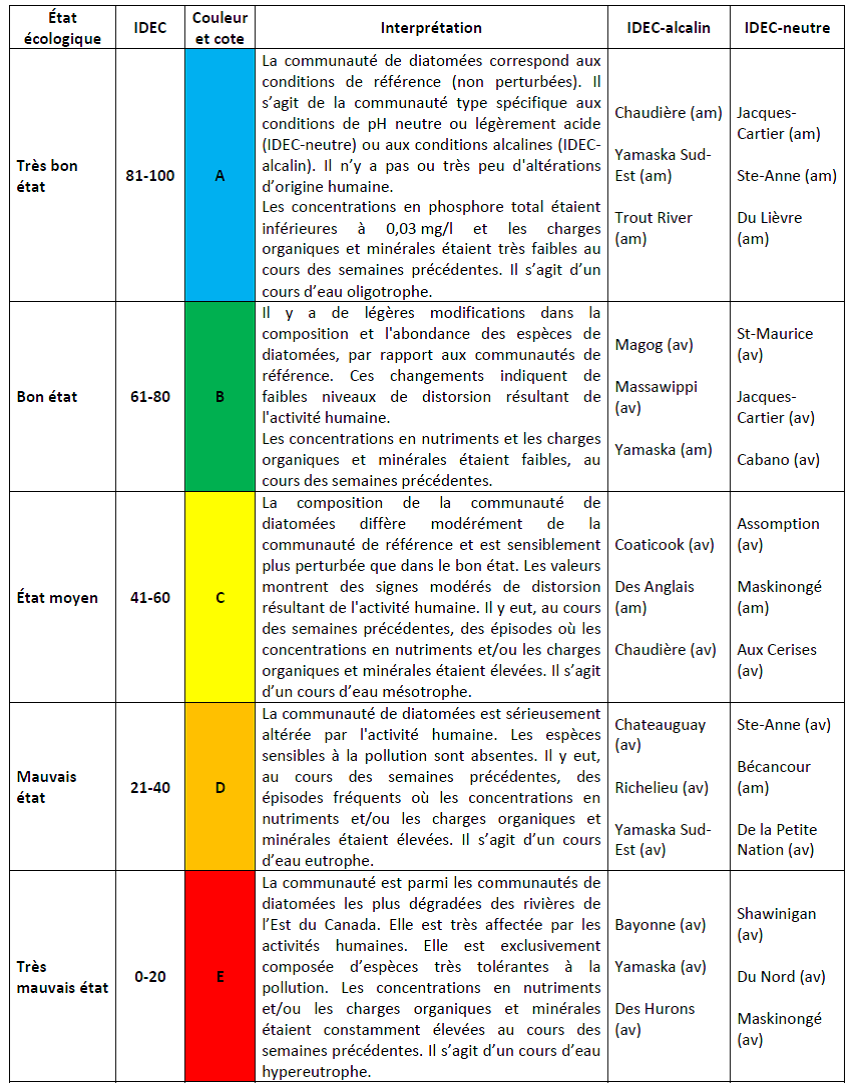
GANGBAZO, G. 2011. Guide pour l’élaboration d’un plan directeur de l’eau : un manuel pour assister les organismes de bassin versant du Québec dans la planification de la gestion intégrée des ressources en eau. Québec, Québec : ministère du Développement durable, de l’Environnement et des Parcs.
HÉBERT, S. 2007. État de l’écosystème aquatique du bassin versant de la rivière Saint-Charles : faits saillants 2003-2005, Québec, ministère du Développement durable, de l’Environnement et des Parcs, Direction du suivi de l’état de l’environnement, ISBN 978-2-550-49604-5 (PDF), 11 p.
HÉBERT, S. 1997. Développement d’un indice de qualité bactériologique et physico-chimique de l’eau pour les rivières du Québec, Québec, ministère de l’Environnement et de la Faune, Direction des écosystèmes aquatiques, envirodoq n°EN/970102, 20 p., 4 annexes.
LAVOIE, I., S. CAMPEAU, M. GRENIER ET P.J. DILLON. 2006. A diatom-based index for the biological assesment of eastern Canadian rivers : an application of correspondence analysis (CA), Canadian Journal of Fisheries Aquatic Sciences, vol. 8, p. 1793-1811.
MINISTÈRE DU DÉVELOPPEMENT DURABLE, DE L’ENVIRONNEMENT ET DE LA LUTTE CONTRE LES CHANGEMENTS CLIMATIQUES (MDDELCC). 2015. Critères de qualité de l’eau de surface. En ligne: http://www.mddelcc.gouv.qc.ca/EAU/criteres_eau/index.asp. Consulté le 16 janvier 2015.
Les milieux aquatiques peuvent être classés en 3 catégories selon leur richesse en éléments nutritifs et leur productivité biologique. Un plan d’eau sera alors décrit comme oligotrophe s’il est pauvre en nutriments et que sa productivité est faible. Il se caractérise par une grande transparence, une importante teneur en oxygène dans sa couche supérieure et des sédiments contenant peu de matières organiques. On qualifie les plans d’eau riches en nutriments d’eutrophes : ils possèdent une forte productivité et une haute biomasse, sont souvent peu profonds avec des sédiments riches en matière organique tout en étant déficients en oxygène de manière saisonnière. Les milieux mésotrophes, dont la productivité est modérée, représentent des états intermédiaires. Il existe également des états de transition entre ces principales classifications (oligo-mésotrophe et méso-eutrophe) de même que des états extrêmes (ultra-oligotrophe et hyper-eutrophe) (MDDELCC, 2015b).
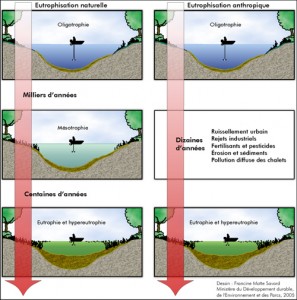
L’eutrophisation est un processus de vieillissement naturel caractérisé par une augmentation de la productivité d’un lac, c’est-à-dire notamment par un accroissement des plantes aquatiques et des algues. C’est un phénomène à l’échelle géologique qui s’étale sur des dizaines de milliers d’années (RAPPEL, 2011). Le passage d’un état oligotrophe à eutrophe, appelé eutrophisation, est l’expression du déséquilibre qui résulte d’un enrichissement excessif des eaux par des nutriments, principalement en phosphore et en azote. Ce phénomène peut survenir de façon naturelle : les plans d’eau « vieillissent » et cette évolution se déroule normalement sur une échelle de temps relativement longue (MDDELCC, 2015b). À l’origine oligotrophes, les plans d’eau peuvent s’enrichir progressivement à partir de sources naturelles. L’eutrophisation est toutefois accélérée par les activités humaines qui prennent place sur les rives et dans les bassins versants des plans d’eau. Ces activités ont pour effet d’augmenter drastiquement les apports en matières nutritives du plan d’eau (MDDELCC, 2015b) notamment en ce qui a trait aux nutriments phosphorés et azotés.
Origine du phosphore
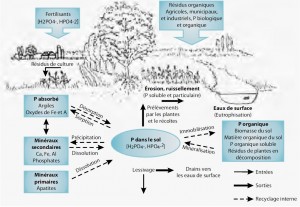
Les apports en phosphore de sources anthropiques dans l’eau de surface proviennent directement des déversements d’eaux usées domestiques et d’effluents industriels ou encore du ruissellement provenant des terres (Gangbazo, 2011), les activités agricoles étant la plus importante source diffuse d’éléments nutritifs dans l’environnement via les charges résiduelles après la récolte (Environnement Canada, 2004). Le phosphore présent dans le sol n’y est pas particulièrement mobile, et les ions phosphate ne se lessivent pas facilement puisqu’ils sont normalement retenus fortement par les particules d’argile, de sol et de matière organique (Gangbazo, 2011). Ces particules, érodées de la couche arable, enrichissent les cours d’eau en phosphore une fois qu’elles y sont entraînées : les ions P se détachent de leur surface (désorption) et se solubilisent. Le P retrouvé dans les plans d’eau peut également provenir de la remise en suspension des sédiments déposés au fond et sur le littoral (Gangbazo, 2011).
Provenances de l’azote
Dans les eaux de surface, l’azote se présente sous plusieurs formes, à savoir l’azote organique, l’azote ammoniacal (NH3), les nitrites (NO2) et les nitrates (NO3). La somme des quatre formes donne l’azote total. L’azote est, pour l’essentiel, transporté dans les rivières sous la forme la plus oxydée et la plus stable, celle des nitrates. Au Québec, les nitrates représentent 70 % des charges d’azote total dans les rivières en milieu agricole, mais représentent seulement 50 % des charges d’azote total dans les rivières en milieu forestier (Gangbazo et Babin, 2000). On considère qu’une rivière qui affiche une concentration d’azote total supérieure à 1 mg/l est sérieusement affectée par des sources d’origine humaine (Gangbazo et Le Page, 2005).
L’azote comme le phosphore sont des éléments nutritifs essentiels au développement des végétaux. Bien que normalement limitant, ils sont désormais disponibles en quantité excessive dans l’environnement. L’augmentation de ces substances nutritives dans les plans d’eau entraîne la prolifération des végétaux aquatiques, des algues ou des cyanobactéries. S’ensuit une diminution de la teneur en oxygène des eaux profondes de même qu’une plus grande accumulation de sédiments et de matières organiques (MDDELCC, 2015b). La qualité de l’eau s’en trouve dégradée et plusieurs usages de l’eau peuvent alors être retreints.
La quantité de végétaux enracinés ou flottants dans les plans d’eau, la présence de cyanobactéries, les concentrations en oxygène dissous et en azote reflètent toutes le niveau d’eutrophisation d’un plan d’eau. Toutefois, ce sont actuellement la charge de l’eau en phosphore couplée à des paramètres associés (la concentration en chlorophylle α et la transparence de l’eau) qui font l’objet de suivi pour évaluer l’état trophique des lacs. Une fois celui-ci déterminé, il est possible de suivre son évolution dans le temps.
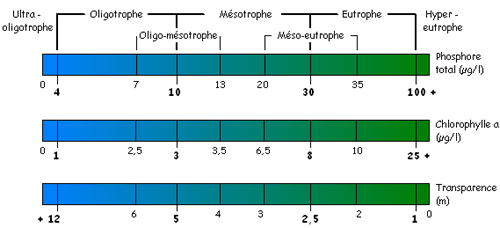
Le niveau trophique d’un plan d’eau varie d’ultra-oligotrophe à hyper-eutrophe. Il est déterminé en mesurant trois variables de surface du lac, soit la concentration du phosphore total, de la biomasse phytoplanctonique (chlorophylle α) et de la transparence. Chacune de ces variables (ou « descriptifs ») est comparée à des valeurs de références suggérées par le MDDELCC, servant à interpréter les données. Elles fournissent leurs propres conclusions sur une même échelle trophique et sont donc de bons indicateurs du concept plus large du stade trophique. Une cote trophique est ensuite attribuée au plan d’eau après l’analyse des paramètres mesurés. Lorsque ceux-ci ne concordent pas, on peut choisir d’utiliser la concentration en chlorophylle α. En effet, il s’agit d’un descriptif biologique intégrateur de la physico-chimie du plan d’eau pris dans son ensemble (Simoneau et al., 2004).
Phosphore total
Le phosphore se trouve principalement sous la forme de phosphates dans les eaux naturelles et les eaux usées. Les différentes formes de phosphore sont l’orthophosphate, ou phosphore réactif, le phosphore hydrolysable et le phosphore. Les formes hydrolysables et organiques se retrouvent principalement sous deux états : soluble ou particulaire (CEAEQ, 2007). Ceux-ci, lorsqu’additionnés, représentent le phosphore total. Ce dernier compte parmi les principaux éléments nutritifs nécessaires à la croissance des algues et limitatifs de leur croissance. Il sert de descripteur pour calculer le niveau trophique d’un plan d’eau, en relation avec les deux autres paramètres.
Transparence de l’eau
La transparence de l’eau est un des indicateurs de qualité de l’eau utilisés pour déterminer l’état trophique d’un plan d’eau. La transparence de l’eau consiste à mesurer la profondeur de pénétration de la lumière. Elle est réduite en fonction de la quantité de matières dissoutes et en suspension, qui peuvent être par exemple des algues et des particules organiques ou inorganiques. Le premier facteur ayant pour effet de diminuer la transparence de l’eau est une quantité élevée de phytoplancton, qui répond directement aux enrichissements en phosphore dans l’eau. La transparence varie aussi en fonction de la couleur de l’eau. Les particules organiques responsables de la coloration résultent de la décomposition de l’humus et des matières organiques dans le bassin versant qui diminuent la transparence. La mesure de carbone organique dissous permet d’évaluer la présence des matières responsables de la coloration jaunâtre ou brunâtre de l’eau et d’en tenir compte dans les mesures de transparence (MDDELCC, 2015b).
Chlorophylle α totale
La chlorophylle α est le pigment principal des organismes photosynthétiques. La concentration de ce pigment dans l’eau fournit un indice de la production primaire photoplanctonique et est utilisée comme indicateur de la biomasse des algues microscopiques. La concentration en chlorophylle α est liée au contenu en phosphore de l’eau. La chlorophylle α totale est un indicateur de la biomasse de phytoplancton présente dans les eaux naturelles. La chlorophylle α peut être un indicateur de la productivité primaire d’un lac, raison pour laquelle elle est utilisée comme indicateur de l’état d’eutrophisation d’un lac. La chlorophylle α totale comprend la chlorophylle α et les phéopigments, les produits de dégradation de chlorophylle α (MDDELCC, 2015b).
Tableau 2.5.3 : Classes des niveaux trophiques des lacs avec les valeurs correspondantes de phosphore total, de chlorophylle α et de transparence de l’eau1 (MDDELCC, 2015b)
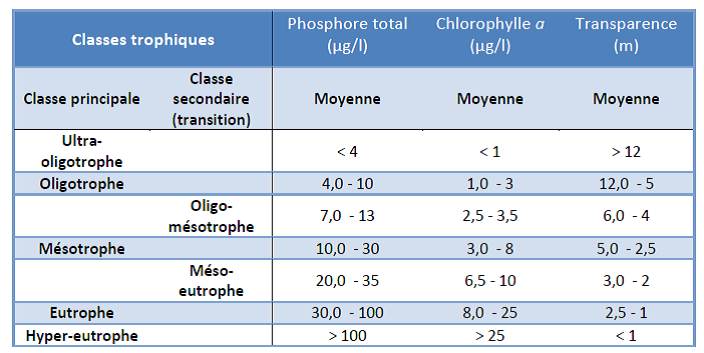
1 Les moyennes réfèrent à la moyenne estivale ou à la moyenne de la période libre de glace. La moyenne estivale correspond à la période durant laquelle il y a une stratification thermique de l’eau entre la surface et le fond du lac pour les lacs suffisamment profonds.
Autres paramètres
Les mesures des descriptifs décrits plus haut permettent de classer les plans d’eau selon leur stade trophique. Toutefois, d’autres indicateurs sont utiles pour évaluer ce stade de façon plus globale, comme l’abondance de plantes aquatiques (MDDELCC, 2015b). Certains descripteurs conventionnels de la qualité de l’eau peuvent également être considérés, tels que la conductivité, le pH, la température et l’oxygène dissous (Painchaud, 1997). De même, les mesures de transparence de l’eau et de chlorophylle α se font dans la colonne d’eau libre au centre du plan d’eau à certains moments au cours de l’année, ce qui peut avoir pour conséquence d’occulter un problème d’eutrophisation présent près des rives, ou encore non détecté aux temps d’échantillonnages. Les indicateurs suivants sont utiles pour déterminer de façon plus globale et à plus long terme l’eutrophisation d’un plan d’eau.
Herbiers aquatiques
L’abondance des macrophytes, enracinés ou non, est représentative des caractéristiques générales du milieu et peut donner des indications sur le niveau trophique d’un plan d’eau. Une augmentation de la densité et de la superficie des herbiers aquatiques ainsi qu’une diminution de la diversité d’espèces qui les composent sont généralement des signes d’eutrophisation (Kalff, 2002; RAPPEL, 2005). La luminosité, le type de substrat, l’apport en éléments nutritifs ainsi que la température et la transparence de l’eau sont tous des paramètres qui influencent le type et la densité de plantes qui colonisent le milieu. Les espèces retrouvées ainsi que leur abondance sont le reflet des conditions du milieu depuis plusieurs années. Un lac qui reçoit, année après année, un apport important en sédiments fins et en éléments nutritifs de son bassin versant, aura une augmentation visible de la densité de ses herbiers et une diminution de la biodiversité des espèces de plantes aquatiques. Le suivi périodique des herbiers autours d’un lac (quantification, emplacement et identification des plantes) permet de détecter l’apparition d’espèces problématiques et/ou envahissantes (APEL, 2009), comme par exemple la châtaigne d’eau européenne (Trapa natans), le myriophylle à épis (Myriophyllum spicatum) et la salicaire pourpre (Lythrum salicaria) (MENV, 2004).
Cyanobactéries
Les cyanobactéries, ou algues bleu-vert, sont des organismes photosynthétiques qui diminuent la transparence de l’eau lorsqu’elles sont en surnombre : elles forment alors une « fleur d’eau ». Leur prolifération est entre autres liée à la concentration en éléments nutritifs des plans d’eau et est fortement corrélée au phénomène d’eutrophisation. Elles peuvent générer une toxicité pouvant causer des problèmes de santé aux usagers. Le MDDELCC a établi que le seuil minimal pour considérer qu’un plan d’eau est touché par une problématique de fleur d’eau d’algues bleu-vert correspond à une densité supérieure ou égale à 20 000 cellules par millilitre. En ce qui concerne les plages organisées, l’exploitant doit effectuer un suivi visuel et tenir un registre quotidien. Lorsqu’une fleur d’eau d’intensité moyenne ou élevée est observée, la baignade et l’accès à tous les secteurs touchés doit être interdit. L’interdiction peut être levée 24 heures après la disparition de la fleur d’eau ou après le retour à une fleur d’eau de faible intensité (MDDELCC, sd). Pour l’eau potable, le seuil de cyanotoxines à ne pas dépasser est fixé à 1 μg/l de microcystine-LR par l’OMS, alors que la concentration maximale acceptable de Santé Canada est de 1,5 μg/l (Groupe scientifique sur l’eau, 2008). Au Québec, le Règlement sur la qualité de l’eau potable prévoit une concentration maximale de mycrocystines de 1,5 μg/l (Gouvernement du Québec, 2015).
Périphyton
Le périphyton est une combinaison d’algues, de cyanobactéries et de détritus auxquels sont associés des organismes benthiques. Il recouvre les roches et les sédiments du littoral des plans d’eau. Sa présence et son abondance constituent un indicateur de la qualité de l’eau et de l’état trophique d’un plan d’eau (EPA, 2011).
Conductivité
La conductivité est une mesure de l’abondance des ions dans l’eau et constitue également un descripteur conventionnel pour l’évaluation de la qualité des eaux (Painchaud, 1997). Selon Painchaud, le Bouclier canadien, composé de roches granitiques, ne démontre pas une tendance à la minéralisation. Ainsi, les eaux de surface du Bouclier canadien ont généralement une faible conductivité.
pH
Le pH est une échelle logarithmique indiquant si une eau est acide (pH plus petit que 7), neutre (pH de 7) ou alcaline (pH plus grand que 7). Les variations du pH pour les eaux de surface peuvent être de cause anthropique (pluies acides) ou naturelle (nature géologique des sols). Ainsi, pour les lacs situés sur le Bouclier canadien, un pH de 6 ou plus qualifie un lac non acide, ce qui est considéré comme étant normal pour la région (Dupont, 2004). L’acidification marquée d’un lac peut représenter un danger pour les communautés aquatiques et être la cause d’un certain appauvrissement du plan d’eau. En effet, les premiers dommages biologiques apparaissent lorsque le pH varie entre 5,5 et 6, tranche où les espèces les plus intolérantes disparaissent (Dupont, 2004).
Température
La stratification thermique est généralement observable au cours des périodes estivales pour les lacs d’une certaine profondeur. Au printemps et à l’automne, la colonne d’eau subit un mélange complet. Ces phénomènes sont dus aux changements de densité de l’eau en fonction de la température (Dodson, 2005). Le profil des températures permet de dresser un portrait des conditions physicochimiques prévalant à chaque strate, soit dans l’épilimnion (strate en surface), le métalimnion (au milieu) et l’hypolimnion (au fond) des lacs. Par ailleurs, les espèces de poissons ont chacune une préférence et un seuil de tolérance aux températures de l’eau. Ainsi, les salmonidés (touladi et omble de fontaine par exemple) préfèrent des eaux froides sous les 20°C (MRNF, 2011).
Oxygène dissous
La mesure de l’oxygène dissous est un paramètre couramment utilisé pour caractériser les écosystèmes aquatiques tels que les lacs et les rivières (Wetzel, 2001). Les concentrations d’oxygène dissous présentent une tendance similaire au profil vertical de température. À la profondeur de l’épilimnion, l’activité planctonique, de par la photosynthèse, est responsable des taux plus élevés d’oxygène retrouvés, tandis que la décomposition de matière organique explique les valeurs nulles de l’hypolimnion (Dodson, 2005). Une réduction de celui-ci dans l’eau constitue un indice de l’eutrophisation des plans d’eau. En effet, la forte production primaire phytoplanctonique, signe d’une eau enrichie en éléments nutritifs, formera un dépôt de matière organique morte au fond du milieu aquatique. La décomposition de celle-ci favorisera la croissance de bactéries hétérotrophes consommatrices d’oxygène dissous : sa concentration dans l’hypolimnion diminuera en conséquence. Par ailleurs, le développement éventuel de plantes flottantes empêchera le passage de la lumière, et réduira donc la photosynthèse dans les couches d’eau inférieures ce qui limitera les échanges avec l’atmosphère et donc l’oxygénation de l’eau. Un seuil minimal de 5 mg/l d’oxygène dissous est parfois recommandé pour assurer la survie de tous les stades de vie des poissons (CCME, 1999), alors que le MDDELCC recommande un seuil minimal de 6 ou 7 mg/l en profondeur (où les températures sont d’environ 5°C) et de 4 ou 5mg/l en surface pour la survie de l’ensemble des organismes vivants d’un plan d’eau (MDDELCC, 2015b). La limite minimale acceptée est de 4 mg/l d’oxygène dissous pour la survie de la majorité des espèces de poissons (Légaré, 1998).
Méthodes d’échantillonnage
Le point le plus profond du lac sert habituellement de lieu d’échantillonnage des paramètres physicochimiques de l’eau (MDDELCC, 2015b). C’est également à cet endroit qu’est évaluée la transparence de l’eau. En plus de constituer une procédure standard, les résultats de la collecte y sont davantage représentatifs de l’ensemble du lac, ce qui permet dès lors des comparaisons d’un plan d’eau à un autre. Les prélèvements se font dans la couche d’eau de surface, entre 0 et 1 mètre. Ils sont conservés au frais jusqu’à l’acheminement à un laboratoire d’analyse, conformément au protocole d’échantillonnage (MDDELCC, 2015b). Pour ce qui est du phosphore total, une bouteille de plastique décontaminée avec quelques gouttes d’acide sulfurique ultra-pure est utilisée pour contenir les prélèvements d’eau. On utilise la méthode par minéralisation au persulfate et dosage par colorimétrie automatisée adaptée pour les teneurs à l’état trace pour déterminer les concentrations en P total. La limite de détection de ce descriptif est de 0,6 µg/l (MDDELCC, 2015b). Les prélèvements destinés à déterminer les concentrations en chlorophylle α sont mis en bouteille de polypropylène opaque, puis dosés par la méthode par fluorométrie, la limite de détection étant de 0,02 µg/l (MDDELCC, 2015b). La transparence de l’eau est mesurée à l’aide d’un disque de Secchi de 20 cm. On obtient cette donnée en mesurant, à partir de la surface du lac, la profondeur à laquelle le disque disparaît et réapparaît à la vue (MDDELCC, 2015b). Les échantillons d’eau destinés à évaluer le carbone organique dissous (COD, qui permettra d’ajuster les mesures de transparence) sont mis en bouteille de plastique contenant quelques gouttes d’acide chlorhydrique. Le COD est dosé par la méthode de détection à l’infrarouge. La limite de détection est de 0,2 mg/l (MDDELCC, 2015b). Pour les autres paramètres, le prélèvement d’échantillons d’eau pour évaluer la densité de cyanobactéries se fait au moment et à l’endroit où la fleur d’eau est la plus intense (par exemple dans l’écume), de préférence tôt le matin ou pendant une journée sans vent (MDDEP et CRE Laurentides, 2009). L’identification du genre et de l’espèce des cyanobactéries, le décompte cellulaire ainsi que le calcul de la biomasse sont effectués par le Centre d’expertise en analyse environnementale du Québec (CEAEQ). L’identification et le dosage de cyanotoxines (microcystine-LR) se font par chromatographie liquide à haute performance couplée à la spectrométrie de masse en tandem (CEAEQ, 2003). L’oxygène dissous se mesure directement dans les plans d’eau, idéalement au centre de ceux-ci où la profondeur de la colonne d’eau est la plus haute, à l’aide d’une multisonde. La limite de détection est de 0,01 mg/l (CRE Laurentides, 2011). La méthode de caractérisation de la végétation présente en pourtour des plans d’eau se fait selon un protocole de caractérisation des herbiers aquatiques développé par le Réseau de surveillance volontaire des lacs. L’ensemble des rives des plans d’eau doit être divisé en secteurs, pour lesquels le nombre et l’abondance d’espèces seront évalués (APEL, 2009).
APEL. 2009. Étude limnologique du haut-bassin de la rivière Saint-Charles, rapport final. Association pour la protection de l’environnement du lac Saint-Charles et des Marais du Nord, Québec, 354 pages.
BOLDUC, Fabien. 2002. Diagnose des lacs Durand et Trois-Lacs, Cantons-Unis de Stoneham et Tewkesbury (sic), rapport présenté par Pro Faune à l’APEL du lac Saint-Charles et des marais du Nord, 56 p. + 3 annexes.
BUREAU D’AUDIENCES PUBLIQUES SUR L’ENVIRONNEMENT. 1988. Rapport d’enquêtes et d’audience publique : Prolongement de l’autoroute 73 vers Stoneham, 70 p.
CANADIAN COUNCIL OF MINISTERS OF THE ENVIRONMENT (CCME). 1999. Canadian water quality guidelines for the protection of aquatic life: Dissolved oxygen (freshwater). Dans: Canadian environmental quality guidelines, 1999, Canadian Council of Ministers of the Environment, Winnipeg.
CONSEIL DE BASSIN DE LA RIVIÈRE SAINT-CHARLES (CBRSC). 2010. Diagnose écologique du lac Neigette, Conseil de bassin de la rivière Saint-Charles, Québec, 55 pages.
CENTRE D’EXPERTISE EN ANALYSE ENVIRONNEMENTALE DU QUÉBEC (CEAEQ). 2007. Détermination du phosphore total dissous et du phosphore total en suspension dans les eaux : dosage par méthode colorimétrique automatisée avec du molybdate d’ammonium, Ministère du Développement durable, de l’Environnement et des Parcs du Québec, 15 pages.
CENTRE D’EXPERTISE EN ANALYSE ENVIRONNEMENTALE DU QUÉBEC (CEAEQ). 2003. Détermination des microcystines dans les eaux de surface et l’eau potable : dosage par chromatographie liquide couplé à un spectromètre de masse de type MS/MS. MA 403 – Microcystis 1.0, Québec, ministère de l’Environnement du Québec, 20 pages.
CONSEIL RÉGIONAL DE L’ENVIRONNEMENT DES LAURENTIDES (CRE Laurentides). 2011. Programme Bleu Laurentides. Suivi complémentaire de la qualité de l’eau: multisonde. En ligne: http://www.crelaurentides.org/images/images_site/dossiers/eau_lacs/bleu_laurentides/suivi_complementaire/Guide_Multisonde.pdf. Consultée le 6 février 2015.
DODSON, S. 2005. Introduction to Limnology. McGraw-Hill, 400 pages
DUPONT, J. 2004. La problématique des lacs acides au Québec, Direction du suivi de l’état de l’environnement, ministère de l’Environnement, envirodoq no ENV/2004/0151, collection no QE/145, 18 p.
ENVIRAM. 2003. Diagnose écologique du lac Delage. Sainte-Foy, 45 p. + annexes.
ENVIRONMENTAL PROTECTION AGENCY (EPA). 2011. Biological Indicators of Watershed Health. Periphyton as Indicators. En ligne: http://www.epa.gov/bioindicators/html/periphyton.html. Consulté le 24 novembre 2011.
ENVIRONNEMENT CANADA. 2004. Menaces pour la disponibilité de l’eau au Canada. Institut national de recherche scientifique, Burlington, Ontario. Rapport no3, Série de rapports d’évaluation scientifique de l’INRE et Série de documents d’évaluation de la science de la DGSAC, numéro 1. 148 pages.
FLEURY, M. 2006. Diagnose écologique et suivi environnement du lac Beauport. Par Faune-Experts inc. pour la Municipalité de Lac Beauport, Rimouski, 34 p. + annexes.
GANGBAZO, G. 2011. Guide pour l’élaboration d’un plan directeur de l’eau : un manuel pour assister les organismes de bassin versant du Québec dans la planification de la gestion intégrée des ressources en eau. Québec, Québec : ministère du Développement durable, de l’Environnement et des Parcs.
GANGBAZO, G. et A. LE PAGE. 2005. Détermination d’objectifs relatifs à la réduction des charges d’azote, de phosphore et de matières en suspension dans les bassins versants prioritaires, Québec, ministère du Développement durable, de l’Environnement et des Parcs, Direction des politiques en milieu terrestre, Envirodoq no ENV/2005/0215, 40 pages.
GANGBAZO, G. et F. BABIN. 2000. Pollution de l’eau des rivières dans les bassins versants agricoles, Vecteur Environnement, vol. 33, no 4, p. 47-57.
GÉNIVAR. 1999. Carte bathymétrique du lac Saint-Charles, réalisée pour la Ville de Québec dans le cadre du Projet de suivi du régime de débit écologique du lac Saint-Charles depuis 1999, carte au 1 : 10 000 avec détail au 1 : 20 000, 2003.
GOUVERNEMENT DU QUÉBEC, 2015. Règlement sur la qualité de l’eau potable. L.R.Q., c. Q-2, r.40. En ligne: http://www2.publicationsduquebec.gouv.qc.ca/dynamicSearch/telecharge.php?type=3&file=/Q_2/Q2R40.HTM. Consulté le 16 janvier 2015.
GROUPE SCIENTIFIQUE SUR L’EAU. 2008. Cyanobactéries et cyanotoxines (eau potable et eaux récréatives). Dans: Fiches synthèses sur l’eau potable et la santé humaine, Institut national de santé publique du Québec, 20 pages.
INSTITUT NATIONAL DE SANTÉ PUBLIQUE DU QUÉBEC (INSPQ). 2005. Critères d’intervention et de seuils d’alerte pour les cyanobactéries. En ligne: www.inspq.qc.ca/pdf/publications/348-CriteresInterventionCyanobacteries.pdf. Consulté le 24 novembre 2011.
KALFF, J. 2002. Limnology. Inland Water Ecosystems. Prentice Hal, New Jersey. 592 p.
LÉGARÉ, S. 1998. Étude limnologique du lac Saint-Charles 1996-1997. Département de biologie de l’Université Laval. 85 p. et annexes.
MINISTÈRE DU DÉVELOPPEMENT DURABLE, DE L’ENVIRONNEMENT ET DE LA LUTTE CONTRE LES CHANGEMENTS CLIMATIQUES (MDDELCC). La gestion des épisodes de fleurs d’eau d’algues bleu-vert. En ligne: http://www.mddelcc.gouv.qc.ca/eau/algues-bv/outil-gestion/gestion-episodes.pdf. Consulté le 15 janvier 2015.
MINISTÈRE DU DÉVELOPPEMENT DURABLE, DE L’ENVIRONNEMENT ET DE LA LUTTE CONTRE LES CHANGEMENTS CLIMATIQUES (MDDELCC). 2015. Critères de qualité de l’eau de surface. En ligne: http://www.mddelcc.gouv.qc.ca/EAU/criteres_eau/index.asp. Consulté le 16 janvier 2015.
MINISTÈRE DU DÉVELOPPEMENT DURABLE, DE L’ENVIRONNEMENT ET DE LA LUTTE CONTRE LES CHANGEMENTS CLIMATIQUES (MDDELCC), 2015 b. Le Réseau de surveillance volontaire des lacs. Les méthodes. En ligne: http://www.mddelcc.gouv.qc.ca/eau/rsvl/methodes.htm. Consulté le 16 janvier 2015.
MINISTÈRE DU DÉVELOPPEMENT DURABLE, DE L’ENVIRONNEMENT ET DES PARCS (MDDEP) et CONSEIL RÉGIONAL DE L’ENVIRONNEMENT DES LAURENTIDES (CRE Laurentides). 2009. Protocole d’échantillonnage de la qualité de l’eau, mai 2009, Québec, MDDEP et CRE Laurentides, ISBN 978-2-550-55699-2. 9 pages.
MINISTÈRE DU DÉVELOPPEMENT DURABLE, DE L’ENVIRONNEMENT ET DES PARCS (MDDEP). 2007. Guide d’élaboration d’un plan directeur de bassin versant de lac et adoption de bonnes pratiques. Direction des politiques de l’eau. Québec, 140 pages.
MINISTÈRE DE L’ENVIRONNEMENT. 2004. Stratégie québécoise sur la diversité biologique 2004-2007 : pour la mise en oeuvre au Québec de la Convention sur la diversité biologique des Nations Unies. Québec, ministère de l’Environnement, Envirodoq ENV/2004/0222, 112 pages.
MINISTÈRE DES RESSOURCES NATURELLES ET DE LA FAUNE (MRNF). Poissons du Québec. Omble de fontaine. En ligne: http://www.mrnf.gouv.qc.ca/faune/peche/poissons/omble-fontaine.jsp. Consulté le 24 novembre 2011.
PAINCHAUD, J. 1997. La qualité de l’eau des rivières du Québec : état et tendances, ministère de l’Environnement et de la Faune, Direction des écosystèmes aquatiques, Québec, 58 p.
RAPPEL. 2011. L’entrophisation (vieillissement) des lacs, En ligne: http://www.rappel.qc.ca/services-et-produits/informations-techniques/lac/eutrophisation.html. Consulté le 09 février 2015.
RIVARD-SIROIS, C., RAPPEL. 2005. Faut-il mépriser les plantes aquatiques? En ligne: http://www.rappel.qc.ca/IMG/pdf/Fiche_technique_10_-_plantes_aquatiques.pdf. Consulté le 24 novembre 2011.
SIMONEAU, M., ROY L. et OUELLET, M. 2004. Info-lacs – Résultats de l’année 2003. Québec, ministère de l’Environnement, Direction du suivi de l’état de l’environnement envirodoq n°ENV/2004/0374, rapport n° QE/152, 14 p.
WETZEL, R. 2001. Limnology: lake and river ecosystems. Academic Press, 1006 pages.
Mis à jour le 16 janvier 2015