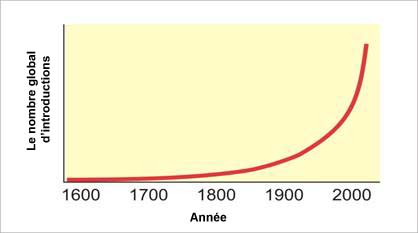
Les espèces végétales ou animales qui s’établissent à l’extérieur de leur aire de répartition naturelle sont appelées espèces exotiques. Bien qu’il puisse s’agir de mouvements naturels, les espèces exotiques sont le plus souvent transportées par l’activité humaine. Ainsi, le nombre global d’introductions d’espèces au Canada a connu une croissance exponentielle depuis le début de la colonisation, avec un bond marqué vers 1900, époque qui a vu une augmentation importante des échanges et des voyages internationaux (Environnement Canada, 2011).
Toutes les espèces exotiques ne sont pas problématiques. Pensons au maïs, au blé ou à la pomme de terre, qui ont été amenés ici par les premiers colons. Certaines espèces, toutefois, causent de grands tords au sein de leur terre d’accueil. On les appelle les espèces exotiques envahissantes. Ainsi, les espèces exotiques envahissantes (EEE) sont des espèces exotiques nocives dont l’introduction ou la propagation menace l’environnement, l’économie ou la société, y compris la santé des êtres humains.
Les espèces exotiques envahissantes constituent une menace pour la biodiversité du Québec. Elles créent un déséquilibre naturel en faisant concurrence pour l’obtention de ressources nécessaires à la survie des espèces indigènes. Cela peut parfois amener des disparitions d’espèces indigènes au profit d’espèces exotiques. Ces dernières peuvent également dégrader les habitats et les ressources en eau ainsi qu’éroder les sols. Enfin, elles transportent souvent des maladies ou des parasites néfastes aux espèces indigènes. C’est le cas du scolyte européen, un insecte porteur du pathogène responsable de la maladie hollandaise de l’orme.
Un secteur d’activité économique reposant sur l’exploitation d’une espèce dont les rendements baissent soudainement peut connaître de graves difficultés. Les pourvoyeurs connaissent d’ailleurs des pertes dans les lacs à truites dues à la compétition occasionnée par la naturalisation de poissons-appâts. De plus, certaines espèces exotiques envahissantes dégradent et endommagent les infrastructures (notamment des prises d’eau) et les coûts associés aux réparations et à la lutte contre ces espèces sont élevés. Des sommes considérables doivent être consacrées, annuellement, pour maintenir ces infrastructures fonctionnelles.
La présence d’espèces exotiques envahissantes a de nombreuses répercussions chez l’homme. En effet, certaines de ces espèces amènent des maladies, telles que le virus du Nil. D’autres sont dangereuses pour la santé. Par exemple, la berce de Caucase (Heracleum mantegazzianum), qui contient des toxines et peut produire des dermatites jusqu’à 48 heures après l’exposition (MSSS, 2011). Enfin, ces espèces peuvent entraîner la réduction d’activités récréatives aquatiques ou terrestres pour des raisons de sécurité.
Les espèces exotiques envahissantes peuvent se propager de diverses façons et leurs voies d’entrée sont nombreuses. Le tableau suivant résume les voies d’entrée possibles pour les espèces aquatiques et terrestres.
Tableau 2.4.1: Voies d’entrée des espèces exotiques au Canada (adapté d’Environnement Canada, 2011).
On recense un si grand nombre d’espèces exotiques envahissantes sur le territoire des bassins versants de la Capitale qu’on ne peut toutes les nommer ici. Certaines espèces sont présentées de façon plus spécifique à la section 3.6 du portrait du territoire. L’analyse qui suit ne se concentre toutefois que sur les éléments problématiques qui ont été recensés pour un cours d’eau ou un milieu humide sur le territoire.
| Bassin versant | Localisation spécifique | Description du problème | Statut |
|---|---|---|---|
| Saint-Charles | Lac Saint-Charles | Présence de myriophylle à épi | Existant |
| Lac Delage | Présence de myriophylle à épi | Existant | |
| Marais du Nord | Présence du roseau commun, utilisé comme élément épurateur | Existant | |
| Rivière Saint-Charles | Captures de gobies à taches noires et d’un poisson à tête de serpent | Existant | |
| Cap Rouge | Rivière du Cap Rouge | Présence de la berce du Caucase à de nombreux endroits dans le bassin versant | Existant |
| Beauport | Rivière Beauport | Présence de moules zébrées dans l’estuaire de la rivière Beauport | Existant |
| Saint-Augustin | Lac Saint-Augustin | Présence de myriophylle à épi | Existant |
| Bordure du Fleuve | Bordure du Fleuve | Présence de moules zébrées dans l’estuaire de la rivière Saint-Charles et dans le bassin Louise | Existant |
| Ensemble du territoire | Ensemble du territoire (voir section 3.6 du portrait du territoire) | Présence, entre autres, du roseau commun, de la berce du Caucase, de la renouée japonaise, du butome à ombelle et de la salicaire pourpre. | Existant |
| Ensemble du territoire | Étangs et plans d’eau de la région | Poissons rouges relâchés dans les étangs et plans d’eau de la région. | Existant |
La diagnose du lac Saint-Charles réalisée en 2007 (APEL, 2009) a révélé la présence du myriophylle à épi (Myriophyllum spicatum) dans le lac Saint-Charles. Quoique le myriophylle à épi n’était pas encore une espèce dominante dans l’écosystème, il présentait un potentiel d’envahissement important. Les observations réalisées en 2012 par l’APEL ont d’ailleurs permis de constater visuellement une progression dans le recouvrement du lac par le myriophylle à épi (Gonzalez, 2012 non publié).
Lors de l’inventaire des herbiers de 2012, le myriophylle à épi a pu être observé jusqu’à une profondeur de 3,4 mètres. Ainsi, la zone d’étude a été délimitée au pourtour du lac, jusqu’à une profondeur maximale de 3,5 m. Le myriophylle à épi recouvre maintenant 18,4 % de l’ensemble du lac, avec une présence nettement plus marquée dans le bassin sud. Ces données doivent toutefois être interprétées avec précaution en raison de la marge d’erreur qui peut survenir lors des observations sur le terrain (Gonzalez, 2012 non publié).
Tableau 2.4.2 : Superficies et pourcentages de recouvrement par le myriophylle à épi calculés pour le lac Saint-Charles au mois d’août 2012 (adapté de Gonzalez, 2012 non publié).
L’apparition du myriophylle à épi dans un plan d’eau peut se faire de façon naturelle, par l’action du vent et des vagues. Toutefois, l’activité humaine est le plus souvent en cause dans la dispersion de la plante. Le passage des embarcations peut notamment créer des fragments qui se déplaceront ensuite au fil de l’eau pour recréer un nouveau plan plus loin, dans le même plan d’eau ou en aval dans le bassin versant (Arsenault et Légaré, 2000)
Le myriophylle à épi est possiblement arrivé au lac Saint-Charles par la décharge du lac Delage, de façon naturelle, ou par l’intervention involontaire de l’homme. Une fois sur place, les caractéristiques favorables du milieu (luminosité, disponibilité en éléments nutritifs, substrat de texture fine) ont contribué au développement et à la prolifération de la plante (CREAT, 2012).
Lorsque le myriophylle à épi s’implante dans un milieu, il forme avec les années de grands herbiers très denses qui limitent la diversité végétale. En éliminant des plantes indigènes par compétition, il nuit à la reproduction de certaines espèces de poissons, tout en favorisant la présence d’autres espèces, notamment des prédateurs, en leur fournissant un abri (CREAT, 2012).
En outre, plusieurs paramètres physicochimiques peuvent être modifiés par la présence du myriophylle. Celui-ci a notamment la capacité de concentrer l’azote et le phosphore (CREAT, 2012). De ce fait, il a également le potentiel de relâcher des quantités importantes de phosphore pour les algues lors de sa décomposition.
La présence de grandes étendues de myriophylle à épi réduit également le taux de pénétration de la lumière, entrave la circulation de l’eau et des sédiments, affecte l’acidité du plan d’eau (augmentation du pH), augmente la température de l’eau et diminue la concentration en oxygène dissous (CREAT, 2012 et Gonzalez, 2012 non publié).
Au-delà des impacts biologiques et physicochimiques, le myriophylle à épi est nuisible pour les activités récréatives puisqu’il s’accroche aux embarcations (hélices des pédalos par exemple) et constitue un environnement peu invitant pour la baignade (qui est toutefois interdite au lac Saint-Charles en raison de son caractère de réservoir d’eau potable).
 L’espèce végétale dominante au lac Delage est le myriophylle à épi. Lors de la diagnose réalisée en 2007, il dominait près de 50% des 31 herbiers recensés et couvrait à lui seul plus de 4% de la superficie du lac (APEL, 2009).
L’espèce végétale dominante au lac Delage est le myriophylle à épi. Lors de la diagnose réalisée en 2007, il dominait près de 50% des 31 herbiers recensés et couvrait à lui seul plus de 4% de la superficie du lac (APEL, 2009).
En utilisant la transparence moyenne de l’eau, l’APEL a évalué la profondeur maximale de colonisation du myriophylle à épi à 4,74 m. Ainsi, celui-ci pourrait théoriquement coloniser jusqu’à 34% de la superficie du lac Delage (APEL, 2009).
La date exacte de l’introduction du myriophylle à épi au lac Delage n’est pas connue, ni sa voie d’entrée. Toutefois, le niveau trophique du lac Delage aurait favorisé sa prolifération. En effet, plus un lac est avancé dans son processus d’eutrophisation, plus il court un risque important d’être colonisé par le myriophylle à épi (Enviram, 2003). Une fois sur place, l’apport en sédiments fins ainsi que la disponibilité d’éléments nutritifs tels que les phosphates et les nitrates contribuent au développement et à la prolifération de cette espèce.
Les concentrations les plus importantes de myriophylle à épi sont situées devant le Manoir du lac Delage. La présence d’une zone littorale peu profonde, l’absence de barrière au ruissellement et au rayonnement solaire ainsi que les activités nautiques intensives dans ce secteur ont pu favoriser sa concentration et sa dispersion (APEL, 2009).
La présence de grandes étendues de myriophylle à épi dans un plan d’eau peut restreindre de façon significative l’utilisation de celui-ci à des fins récréatives. Le myriophylle nuit au passage des embarcations et la baignade devient peu invitante. La pêche s’en trouve également affectée et reléguée au centre du lac.
En outre, le myriophylle à épi peut contribuer à accélérer le processus d’eutrophisation d’un lac. En effet, la plante se nourrit de l’azote et du phosphore contenu dans les sédiments situés au fond du lac. Ce faisant, ces éléments deviennent disponibles pour les algues suite à la décomposition de la plante (Enviram, 2003). En contrepartie, le myriophylle à épi libère des substances qui perturbent la croissance de certaines espèces d’algues, notamment des cyanobactéries (Enviram, 2003).
Dans la diagnose réalisée en 2003 par Enviram, on note une augmentation importante de la transparence de l’eau entre le début des années 1980 (période de développement importante pour la Ville), et 1999. À cet égard, le myriophylle à épi aurait pu contribuer à cette amélioration de la transparence. Toutefois, cette transparence contribue à la colonisation des zones plus profondes du lac par le myriophylle (Enviram, 2003).
On observe la présence du roseau commun (Phragmites australis) aux marais du Nord, celui-ci étant utilisé comme élément épurateur.
D’autres sites à usage commercial, institutionnel ou communautaire sur le territoire auraient également fait appel à cette technologie dans les dernières années. Les localisations spécifiques ne sont toutefois pas documentées.
L’adoption de cette technique était, au moment de son implantation, la seule solution possible en fonction des connaissances de l’époque, compte tenu de l’achalandage prévu et des conditions physiques du milieu récepteur. Les connaissances et les pratiques ont toutefois évolué depuis. Ainsi, le MDDEP et le promoteur ont convenu, en 2009, que le roseau commun soit progressivement remplacé par la quenouille (Typha sp.) ou le scirpe (Scirpus sp.) dans le procédé d’épuration des eaux usées. Une période de transition est prévue entre le 1er janvier 2010 et le 30 juin 2014, pendant laquelle l’utilisation du roseau commun comme élément épurateur sera limitée à un territoire prédéterminé par le Ministère, et soumis à son autorisation préalable. Au-delà du 30 juin 2014, le roseau commun ne sera plus utilisé comme élément épurateur (Gouvernement du Québec, 2012, Goupe Phragmites, 2009).
Depuis son implantation en 2005, l’étendue du roseau commun est demeurée à l’intérieur du marais épurateur et la plante n’a pas été retrouvée dans d’autres secteurs des marais du Nord. L’Association pour la protection de l’environnement du lac Saint-Charles et des marais du Nord s’assure d’un suivi étroit.
 En 2008, 2009 et 2010, la Société de la rivière Saint-Charles a capturé le gobie à taches noires (Neogobius melanostomus) dans la rivière Saint-Charles à la hauteur de la marina Saint-Roch lors de pêches à la bourrole. En 2011, aucune capture de gobie n’a eu lieu (Deschamps, 2012) alors qu’en 2012, la Société de la rivière Saint-Charles a observé un gobie à taches noires dans un ruisseau sans nom du bassin versant de la rivière du Berger à la hauteur du parc de l’Escarpement (Auclair, 2012).
En 2008, 2009 et 2010, la Société de la rivière Saint-Charles a capturé le gobie à taches noires (Neogobius melanostomus) dans la rivière Saint-Charles à la hauteur de la marina Saint-Roch lors de pêches à la bourrole. En 2011, aucune capture de gobie n’a eu lieu (Deschamps, 2012) alors qu’en 2012, la Société de la rivière Saint-Charles a observé un gobie à taches noires dans un ruisseau sans nom du bassin versant de la rivière du Berger à la hauteur du parc de l’Escarpement (Auclair, 2012).
En 2010, un poisson tête-de-serpent d’Indonésie (Channa micropeltes) a été trouvé mort près de l’embouchure de la rivière Saint-Charles. Aucune autres capture ou observation n’ont étés recensées depuis.
Le gobie à taches noires est une espèce introduite accidentellement avec les eaux de ballast des navires marchands. Il a été découvert pour la première fois dans le fleuve Saint-Laurent en 1997. On le trouve maintenant jusqu’à la hauteur de Montmagny.
De son côté, le poisson tête-de-serpent d’Indonésie est très prisé sur les marchés de nourriture asiatique et vendu sur le marché de l’Amérique du Nord et dans les animaleries (MRNF, 2011c). Tout porte à croire que le poisson tête-de-serpent d’Indonésie aurait été relâché par son propriétaire.
Le gobie à taches noires, petit poisson benthique, se montre très agressif envers les espèces indigènes, en mangeant leurs œufs et leurs jeunes. Prédateur de la moule zébrée (Dreissena polymorpha), il contribue à réintroduire dans la chaîne alimentaire les contaminants accumulés par ces dernières. Enfin, le gobie peut être porteur de la septicémie hémorragique virale, qui peut être transmise aux espèces indigènes et entraîner leur mort (MRN, 2012). La présence du gobie à taches noires dans un cours d’eau peut donc entraîner des conséquences importantes sur les populations ichtyennes et sur la qualité de la pêche sportive.
En ce qui concerne le poisson tête-de-serpent, l’espèce qui a été retrouvée ne tolère pas les rigueurs de l’hiver. Il n’y a donc pas d’effets sur l’écosystème pour l’instant. Toutefois, au moins trois espèces de la même famille ont réussi à s’établir dans quelques états américains où elles représentent une menace pour les populations locales de poissons (MRNF, 2010). Le poisson à tête de serpent du Nord peut survivre dans des températures froides, ce qui rend cette espèce très menaçante puisqu’elle a le potentiel de s’établir dans la majeure partie de l’Amérique du Nord (MRN, 2012b). Il importe donc d’être vigilant et de ne pas relâcher dans l’écosystème des espèces d’aquarium.
La berce du Caucase est omniprésente le long des berges de de la rivière du Cap Rouge et des ruisseaux Guillaume et à l’Eau Claire. L’espèce tend également à se propager en dehors du corridor cours d’eau, notamment dans certains fossés agricoles. Le Conseil de bassin de la rivière du Cap Rouge procède à la surveillance des berges et arrache systématique les plants, permettant ainsi de limiter l’envahissement.
La berce du Caucase est originaire d’Eusasie et a été introduite en Amérique du Nord au début du 20e siècle à des fins horticoles. Sa présence a été répertoriée pour la première fois au Québec en 1990. Les milieux frais et humides sont propices à son développement. Les semences étant efficacement propagées par les cours d’eau, on observe souvent une colonisation massive des berges et des milieux avoisinants. Dans le cas spécifique du bassin de la rivière du Cap Rouge, la berce du Caucase aurait été introduite de façon involontaire en amont du sous-bassin versant du ruisseau à l’Eau Claire (Conseil de bassin de la rivière du Cap Rouge, 2014).
La berce du Caucase jouit d’une croissance rapide qui, combinée à sa grande taille, favorise la formation de peuplements monospécifiques qui menacent la biodiversité et perturbent les écosystèmes riverains. La berce du Caucase peut également représenter un problème de santé publique. La sève de la plante renferme en effet des substances chimiques qui, au contact de la peau et lorsque celle-ci est exposée à la lumière, peuvent causer des phytodermatites. Les brûlures qui en découlent guérissent lentement et la peau demeure photosensible pendant quelque temps (Conseil de bassin de la rivière du Cap Rouge, 2014).
 De petites moules zébrées ont été observées dans l’estuaire de la rivière Beauport en 2011 lors de travaux terrain réalisés par l’OBV de la Capitale.
De petites moules zébrées ont été observées dans l’estuaire de la rivière Beauport en 2011 lors de travaux terrain réalisés par l’OBV de la Capitale.
Suite à son introduction accidentelle dans les années 1980, la moule zébrée est maintenant bien établie dans le bassin Grands Lacs-Saint-Laurent (Environnement Canada, 2010). La moule zébrée est présente dans l’ensemble du corridor fluvial jusqu’à Montmagny, où la salinité des eaux freine son expansion vers l’aval (Environnement Canada – Centre Saint-Laurent, 2000).
Étant donné que le substrat est très meuble, une colonisation importante de moules zébrées dans ce secteur n’est pas probable pour le moment (Blais, 2011).
En 1992, on notait la présence du myriophylle à épi dans le lac Saint-Augustin, (Landry 1988 et 1992 dans Bergeron, M., C. Corbeil, et S. Arsenault, 2002). Aucune étude récente des herbiers n’a été faite au lac Saint-Augustin.
L’arrivée du myriophylle à épi dans un plan d’eau peut se faire de façon naturelle, par l’action du vent, des vagues, ou de la faune. Toutefois, l’action de l’humain est souvent en cause. Au lac Saint-Augustin, la présence d’hydravions et d’embarcations à moteur a probablement contribué à transporter ces deux espèces d’un plan d’eau affecté vers le lac Saint-Augustin.
En raison du fait que les dernières études d’herbiers remontent à plus de 20 ans, il est difficile de mesurer les effets de la présence de cette plante envahissante au lac Saint-Augustin. Un nouvel inventaire des herbiers doit être fait.
Des relevés faits entre 1992 et 1998 démontrent la présence de moules zébrées dans le bassin Louise. On y a alors dénombré des concentrations allant jusqu’à un peu plus de 20 000 individus au mètre carré (Environnement Canada – Centre Saint-Laurent, 2000). Notons toutefois que la moule zébrée peut atteindre des densités de l’ordre de 200 000 à 300 000 individus au mètre carré (Villeneuve, 2001, et Environnement Canada – Centre Saint-Laurent, 2000). Nous n’avons pas de données plus récentes sur les colonies de moules zébrées à cet endroit.
Tableau 2.4.3 : Abondance (moyenne par mètre carré) de moules zébrées sur les roches et murets à différentes stations dans le fleuve Saint-Laurent (adapté de Environnement Canada – Centre Saint-Laurent, 2000).
La moule zébrée a été introduite accidentellement dans les Grands Lacs, dans les années 1980 (par la vidange des eaux de ballast) et la première mention officielle remonte à 1988, dans le lac Sainte-Claire, en Ontario (MRN, 2012c). La moule zébrée est maintenant bien établie dans le bassin Grands Lacs-Saint-Laurent (Environnement Canada, 2010) et est présente dans l’ensemble du corridor fluvial jusqu’à Montmagny, où la salinité des eaux freine son expansion vers l’aval (Environnement Canada – Centre Saint-Laurent, 2000).
Parmi les effets recensés sur les impacts généraux de la moule zébrée dans un plan d’eau, notons le colmatage des canalisations, la corrosion de la coque des navires, les pertes d’habitats et la perturbation des écosystèmes (Environnement Canada – Centre Saint-Laurent, 2000). Nous n’avons pas d’information sur les effets directs de la présence de la moule zébrée dans le bassin Louise.
La présence de la moule zébrée à proximité de la rivière Saint-Charles est également préoccupante. Toutefois, la présence du barrage Joseph-Samson a très probablement contribué à prévenir l’envahissement de la basse Saint-Charles par la moule zébrée. À cet égard, il y a quelques années, le ministère des Ressources naturelles et de la Faune a fait une évaluation de la colonisation potentielle de certains cours d’eau et lacs par la moule zébrée. Cette évaluation a été réalisée à deux endroits sur la rivière Saint-Charles: au pont de la rue Morissette, dans la haute Saint-Charles, et au pont de la rue Scott, à quelques kilomètres de l’embouchure. Pour les deux stations, deux paramètres ont été mesurés : le pH était respectivement de 7,4 et 7,7 et le calcium, de 8,25 et 30,00 mg/l. Les diagnostics révélaient ainsi un potentiel de colonisation inexistant pour la station du pont de la rue Morissette et un potentiel de colonisation très élevé pour la station de la rue Scott (MRN, 2013 et Brodeur, Meunier et Trépanier, 2008).
Au printemps 2013, l’OBV de la Capitale et le ministère des Ressources naturelles ont procédé à une pêche à la seine dans un plan d’eau de la région, dans le but de contrôler l’invasion du milieu aquatique par des espèces envahissantes de poissons, vraisemblablement introduits par des aquariophiles. Plus d’un millier de poissons ont alors été retirés du plan d’eau, dont certains atteignaient des proportions impressionnantes.
Les espèces exotiques envahissantes peuvent se propager de diverses façons et leurs voies d’entrée sont nombreuses. En ce qui concerne plus spécifiquement les espèces aquatiques, les voies d’entrée non négligeables sur le territoire sont l’aquariophilie et les jardins d’eau. Pour une raison ou une autre, il arrive qu’un propriétaire de poissons veuille s’en départir, mais souhaite leur donner une chance de survie en les relâchant dans les cours d’eau, étangs ou lacs de la région.
Les espèces envahissantes constituent une menace pour la biodiversité du Québec. Elles créent un déséquilibre naturel en faisant concurrence pour l’obtention de ressources nécessaires à la survie des espèces indigènes. Cela peut parfois amener des disparitions d’espèces indigènes au profit d’espèces exotiques, ou encore la dégradation d’habitats. Si certaines espèces tropicales ne peuvent survivre à la rigueur de nos hivers, certains poissons, rejetés par leur propriétaire, peuvent se reproduire rapidement et coloniser les habitats des espèces indigènes. Le poisson rouge, espèce que l’on peut se procurer dans presque toutes les animaleries de la région, entre dans cette catégorie.
Sur le territoire de l’OBV de la Capitale, on retrouve dans certains plans d’eau une présence accrue de plantes aquatiques indigènes. Même s’il ne s’agit pas d’espèces exotiques, leur abondance est parfois problématique. Citons entre autres l’élodée du Canada (Elodea canadensis) et le potamot de Robbins (Potamogeton robbinsii) qui prolifèrent facilement et atteignent des niveaux nuisibles lorsque les plans d’eau sont enrichis en nutriments.
Lorsque qu’un plan d’eau est enrichi en éléments nutritifs utiles à la croissance des plantes, leur prolifération perturbe l’écosystème. La biomasse végétale se trouve alors en excédant comparée aux capacités d’assimilation du zooplancton, du benthos et des poissons. La décomposition de la matière organique par les bactéries augmente alors, provoquant ainsi un épuisement de l’oxygène disponible pour certaines espèces de poissons et d’invertébrés. Ce sont donc les espèces les plus tolérantes qui sont favorisées par cette perturbation. Il est même possible de voir la disparition de certaines espèces, générant, donc, une perte de biodiversité. Il est aussi important de mentionner qu’une trop grande abondance de plantes aquatiques peut avoir un impact sur le taux de lumière pénétrant dans la colonne d’eau, la circulation de l’eau et des sédiments, l’acidité et la température de l’eau et la concentration en oxygène et en phosphore. De plus, une abondance de plantes aquatiques peut devenir une nuisance du point de vue esthétique ou encore pour les activités récréatives (Le RAPPEL, 2012).
La présence de l’élodée du Canada a été observée dans plusieurs plans d’eau du territoire. Cette espèce n’est pas à proprement parler une espèce exotique envahissante, puisque sa zone naturelle de répartition couvre à peu près toute l’Amérique du Nord (espèce indigène). Toutefois, elle a un potentiel d’envahissement très important et sa présence doit être surveillée. En effet, elle prolifère facilement et atteint des niveaux nuisibles lorsque les cours d’eau ou plans d’eau sont enrichis en nutriments. L’élodée du Canada est une plante aquatique submergée commune dans nos régions. Cette plante mesure généralement moins d’un mètre et croît en colonies souvent très denses et étendues. Elle possède de nombreuses petites feuilles vert foncé ainsi que de minuscules fleurs blanchâtres qui flottent à la surface de l’eau au bout d’une longue queue. L’élodée colonise les eaux tranquilles des lacs et des étangs. Elle s’enracine préférentiellement dans un à trois mètres d’eau, mais s’adapte aussi à des secteurs plus profonds. Elle s’installe sur divers substrats, mais principalement sur la vase ou le sable. Elle tolère différents degrés d’eutrophisation. Finalement, l’élodée du Canada, généralement considérée moyennement limitante, possède un potentiel d’envahissement élevé, étant donné qu’elle peut se multiplier par drageonnement et par bouturage (Le RAPPEL, 2012).
Le potamot de Robbins, une espèce indigène surtout présente dans l’ouest du Québec, a également été répertorié dans certains plans d’eau. Le potamot de Robbins pousse dans les lacs et étangs calmes où l’eau est peu profonde. Ses rigides et linéaires feuilles brunâtres ou rougeâtres sont disposées sur deux rangs de part et d’autre de la tige. Cette plante, à l’apparence d’une plume, mesure environ 50 cm. Son feuillage sert de nourriture pour plusieurs organismes aquatiques. Le potamot de Robbins semble vivre principalement dans les fonds vaseux à différentes profondeurs. Ce potamot détient un potentiel d’envahissement élevé (Le RAPPEL, 2012).
| Bassin versant | Localisation spécifique | Description du problème | Statut |
|---|---|---|---|
| Saint-Charles | Lac Saint-Charles | Présence de l’élodée du Canada et du potamot de Robbins | Existant |
| Lac Clément | Présence du potamot de Robbins | Existant | |
| Lac Beauport | Présence de l’élodée du Canada | Existant | |
| Lac Neigette | Présence de l’élodée du Canada | Existant | |
| Saint-Augustin | Lac Saint-Augustin | Présence |
Existant |
La présence de l’Élodée du Canada a été notée en 2007 et en 2012 au lac Saint-Charles. En 2012, c’est 69 herbiers sur les 125 recensés où l’on retrouvait de l’élodée, avec un pourcentage de recouvrement de 11,8%, principalement dans le bassin nord du lac. Cette même étude relève aussi la présence du Potamot de Robbins dans 36/125 herbiers recensés.(Gonzalez, 2012 non publié).
Le lac Saint-Charles fait partie de la zone de distribution naturelle de l’élodée du Canada et du Potamot de Robbins. À l’image du myriophylle à épi (Myriophyllum spicatum), l’élodée du Canada se propage très facilement par reproduction végétative. Le Potamot, quand à lui, recouvre le sol de plusieurs lacs au Québec et a naturellement tendance à former de denses colonies.
Contrairement au myriophylle à épi, l’élodée du Canada envahit le fond des plans d’eau plutôt que la surface. Elle a donc des effets sur les activités récréatives, notamment la baignade et la pêche. En outre, son aptitude à faire augmenter le pH d’un plan d’eau lorsque présente en grand nombre peut perturber l’équilibre physicochimique et écosystémique d’un plan d’eau. De même, elle peut réduire la vitesse d’écoulement de l’eau, entraîner une diminution de l’oxygène dissous et de l’intensité lumineuse, et provoquer une accélération de la sédimentation des matières organiques et conséquemment, une accélération du phénomène d’eutrophisation du plan d’eau (Fédération des Conservatoires botaniques nationaux, s/d). Enfin, sa forte capacité de colonisation du milieu entraîne une réduction de la richesse spécifique du plan d’eau (Fédération des Conservatoires botaniques nationaux, s/d).
Les effets de la présence du Potamot de Robbins au lac Saint-Charles n’ont pas été étudiés.
En 2012, l’APEL a inventorié du Potamot de Robbins dans le lac Clément dans 24 des 125 herbiers recensés (Gonzalez, 2012 non publié).
Le lac Clément fait partie de la zone de distribution naturelle du Potamot de Robbins.
Les effets de la présence du Potamot de Robbins au lac Clément n’ont pas été étudiés.
La dernière étude des herbiers du lac Beauport remonte à la diagnose réalisée en 2000. Dans cet ouvrage, on ne fait pas mention de la présence de l’élodée du Canada dans le lac (Bolduc, 2000). La prolifération au lac Beauport s’est donc vraisemblablement produite entre 2000 et 2008, puisqu’en 2009 et 2010, les journaux locaux font état d’un problème d’envahissement des herbiers par l’élodée du Canada (Municipalité de Lac-Beauport, 2009 et 2010 et Écho du lac, 2009 et 2010).
La diagnose du lac Neigette réalisée en 2009 a révélé la présence de l’élodée du Canada dans le lac. L’espèce n’était toutefois pas très répandue à cette date, n’étant répertoriée que dans l’un des 47 secteurs inventoriés autour du lac (Conseil de bassin de la rivière Saint-Charles, 2010).
Le lac Beauport et le lac Neigette font partie de la zone de distribution naturelle de l’élodée du Canada. Toutefois, cette plante n’a pas été recensée lors de l’étude des herbiers réalisée en 2000 dans le lac Beauport (Bolduc, 2000). On peut donc supposer que l’introduction s’est faite dans les années qui ont suivi, par voie naturelle (vent, faune) ou accidentelle.
En ce qui concerne le lac Neigette, la faible quantité d’élodée du Canada recensée laisse supposer que l’introduction arrivée est récente. En 2009, on comptait 52 unités d’habitation dans le bassin versant, et seulement 4 habitations autour du lac (Conseil de bassin de la rivière Saint-Charles, 2010). Bien que l’introduction accidentelle par l’homme soit possible, l’introduction par le transport aviaire semble plus plausible. L’année 2009 correspond à cet égard à une période où l’élodée du Canada était présente en grande quantité au lac Beauport, plan d’eau situé à proximité du lac Neigette.
Contrairement au myriophylle à épi, l’élodée du Canada envahit le fond des plans d’eau plutôt que la surface. Elle a donc des effets sur les activités récréatives, notamment la baignade et la pêche. En outre, son aptitude à faire augmenter le pH d’un plan d’eau lorsque présente en grand nombre peut perturber l’équilibre physicochimique et écosystémique d’un plan d’eau. De même, elle peut réduire la vitesse d’écoulement de l’eau, entraîner une diminution de l’oxygène dissous et de l’intensité lumineuse, et provoquer une accélération de la sédimentation des matières organiques et conséquemment, une accélération du phénomène d’eutrophisation du plan d’eau (Fédération des Conservatoires botaniques nationaux, s/d). Enfin, sa forte capacité de colonisation du milieu entraîne une réduction de la richesse spécifique du plan d’eau (Fédération des Conservatoires botaniques nationaux, s/d).
Une étude de 1988 mentionne la présence de l’élodée du Canada au lac Saint-Augustin. Quatre ans plus tard, on notait la présence du myriophylle à épi dans le lac Saint-Augustin, qui semblait prendre progressivement la place de l’élodée du Canada (Landry 1988 et 1992 dans Bergeron, M., C. Corbeil, et S. Arsenault, 2002). Aucune étude récente des herbiers n’a été faite au lac Saint-Augustin.
Le lac Saint-Augustin fait partie de la zone de distribution naturelle de l’élodée du Canada. À l’image du myriophylle à épi, l’élodée du Canada se propage très facilement par reproduction végétative.
Contrairement au myriophylle à épi, l’élodée du Canada envahit le fond des plans d’eau plutôt que la surface. Elle a donc des effets sur les activités récréatives, notamment la baignade et la pêche. En outre, son aptitude à faire augmenter le pH d’un plan d’eau lorsque présente en grand nombre peut perturber l’équilibre physicochimique et écosystémique d’un plan d’eau. De même, elle peut réduire la vitesse d’écoulement de l’eau, entraîner une diminution de l’oxygène dissous et de l’intensité lumineuse, et provoquer une accélération de la sédimentation des matières organiques et conséquemment, une accélération du phénomène d’eutrophisation du plan d’eau (Fédération des Conservatoires botaniques nationaux, s/d). Enfin, sa forte capacité de colonisation du milieu entraîne une réduction de la richesse spécifique du plan d’eau (Fédération des Conservatoires botaniques nationaux, s/d).
APEL. 2009. Étude limnologique du haut-bassin de la rivière Saint-Charles, rapport final. Association pour la protection de l’environnement du lac Saint-Charles et des Marais du Nord, Québec, 354 pages.
ARSENAULT, S. ET S. LÉGARÉ. 2000. L’envahissement de nos lacs par une espèce exotique – Le cas du myriophylle à épi (Myriophyllum spicatum). Le naturaliste canadien, Vol. 124 No 1, page 39 à 43.
AUCLAIR, G. 2012. Société de la rivière Saint-Charles. Communication personnelle, 5 octobre 2012.
BLAIS, S. 2011. Pêches et Océans Canada, communication personnelle.
BERGERON, M., C. CORBEIL, et S. ARSENAULT. 2002. Diagnose écologique du lac Saint-Augustin. Document préparé pour la municipalité de Saint-Augustin-de-Desmaures par EXXEP Environnement, Québec, 70 pages et 6 annexes.
BOLDUC, F. 2000. Diagnose écologique du lac Beauport. Rapport final présenté par Pro Faune à la municipalité de Lac-Beauport, 44 pages + 1 annexe.
BRODEUR, C., C. MEUNIER et TRÉPANIER, J. 2008. Diagnostic du bassin de la rivière Saint-Charles. Conseil de bassin de la rivière Saint-Charles, Québec, 45 p.
CONSEIL DE BASSIN DE LA RIVIÈRE DU CAP ROUGE. 2014. Rapport de caractérisation de six espèces exotiques envahissantes dans le bassin versant de la rivière du Cap Rouge. Québec, 15 p.
CONSEIL DE BASSIN DE LA RIVIÈRE SAINT-CHARLES (CBRSC). 2010. Diagnose écologique du lac Neigette. 55 p.
CONSEIL RÉGIONAL DE L’ENVIRONNEMENT DE L’ABITIBI-TÉMISCAMINGUE (CREAT). 2012. Myriophylle en épi (Myriophyllum spicatum) Eurasian water-milfoil. En ligne: http://www.creat08.ca/even_plantes/5.htm. Consulté le 13 novembre 2012.
DESCHAMPS, G. 2011. Société de la rivière Saint-Charles. Communication personnelle, 2011.
ENVIRAM. 2003. Diagnose écologique du lac Delage. Ville de Lac-Delage, 45 pages + annexes.
ENVIRONNEMENT CANADA – CENTRE SAINT-LAURENT. 2000. Présence de la moule zébrée dans le Saint-Laurent : à suivre… Centre Saint-Laurent. En ligne : http://www.bape.gouv.qc.ca/sections/mandats/prise_eau/documents/DA19.pdf. Consulté le 16 février 2015.
ENVIRONNEMENT CANADA. 2010. Moule zébrée. En ligne: http://www.ec.gc.ca/stl/default.asp?lang=Fr&n=1791EA71-1. Consulté le 12 novembre 2012.
ENVIRONNEMENT CANADA. 2011. Espèces exotiques envahissantes au Canada. En ligne: http://www.ec.gc.ca/eee-ias/Default.asp?lang=Fr&n=C4637128-1. Consulté le 9 novembre 2012.
FÉDÉRATION DES CONSERVATOIRES BOTANIQUES NATIONAUX, s/d. Elodea canadensis Michaux. Fiche technique, 6 pages.
GONZALEZ, S. 2012. Diagnose du lac Saint-Charles et du lac Clément – Les herbiers aquatiques. Association pour la protection de l’environnement du lac Saint-Charles et des Marais du Nord (APEL), Québec, 112 pages + annexes (non publié).
GOUVERNEMENT DU QUÉBEC. 2012. Fiche d’information technique – Écophyltre P. 10 pages.
GROUPE PHRAGMITES. 2009. Bulletin d’information sur les travaux en cours sur l’écologie et la gestion du roseau commun (Phragmites australis) au Québec. No 15, septembre 2009, 4 pages.
L’ÉCHO DU LAC. 2010. Septembre 2009 | vol. 4 numéro 1
L’ÉCHO DU LAC. 2010. Juillet 2010 | vol. 4 numéro 11
RAPPEL. 2012. Les plantes aquatiques. En ligne: http://rappel.qc.ca/services-et-produits/informations-techniques/lac/plantes-aquatiques.html. Consulté le 11 février 2015.
MINISTÈRE DES RESSOURCES NATURELLES ET DE LA FAUNE (MRNF). 2010. Pleins feux sur… une espèce exotique envahissante, le poisson tête-de-serpent. En ligne: http://education.mrnf.gouv.qc.ca/chronique/capsule/pleins-feux-sur-une-espece-exotique-18.html. Consulté le 15 novembre 2012.
MUNICIPALITÉ DE LAC-BEAUPORT. 2009. La Chronique, Volume 31 • No 8 • Septembre-Octobre 2009.
MUNICIPALITÉ DE LAC-BEAUPORT. 2010. La Chronique, Volume 32 • No 7 • 16 août 2010.
MINISTÈRE DES RESSOURCES NATURELLES QUÉBEC (MRN). 2013. La colonisation potentielle par la moule zébrée – banque de données. En ligne: http://www.fapaq.gouv.qc.ca/fr/environn/moule/index.asp. Consulté le 16 janvier 2013.
MINISTÈRE DES RESSOURCES NATURELLES QUÉBEC (MRN). 2012. Le gobie à taches noires. En ligne: http://www.mffp.gouv.qc.ca/faune/especes/envahissantes/gobie.jsp. Consulté le 13 février 2015.
MINISTÈRE DES RESSOURCES NATURELLES QUÉBEC (MRN). 2012 b. Le poisson à tête de serpent. En ligne: http://www.mffp.gouv.qc.ca/faune/especes/envahissantes/tete-serpent.jsp. Consulté le 13 février 2015.
MINISTÈRE DES RESSOURCES NATURELLES QUÉBEC (MRN). 2012 c. La moule zébrée. En ligne: http://www.mffp.gouv.qc.ca/faune/especes/envahissantes/moule-zebree.jsp. Consulté le 13 février 2015.
Mis à jour le 27 août 2015